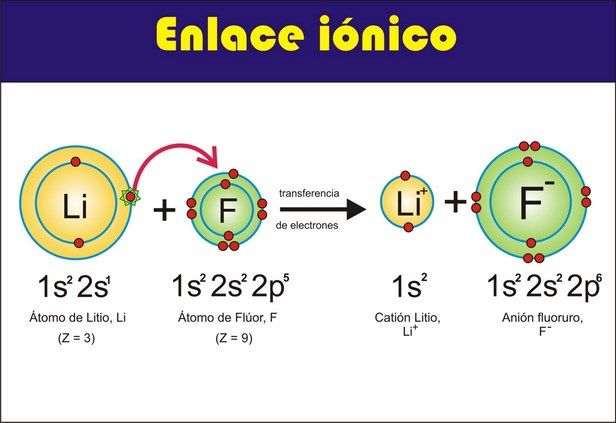
Este enlace se produce cuando átomos de elementos metálicos (especialmente los situados más a la izquierda en la tabla periódica -períodos 1, 2 y 3) se encuentran con átomos no metálicos (los elementos situados a la derecha en la tabla periódica -especialmente los períodos 16 y 17). En este caso los átomos del metal ceden electrones a los átomos del no metal, transformándose en iones positivos y negativos, respectivamente. Al formarse iones de carga opuesta éstos se atraen por fuerzas eléctricas intensas, quedando fuertemente unidos y dando lugar a un compuesto iónico. Estas fuerzas eléctricas las llamamos enlaces iónicos. |
- Sus enlaces son muy fuertes (depende fuertemente de la naturaleza de los iones).
- Son sólidos a temperatura ambiente y poseen una estructura cristalina en el sistema cúbico.
- Altos puntos de fusión (entre 300 °C y 1000 °C) y ebullición (Si el enlace tiene un carácter covalente alto, puede ser que estos valores disminuyan abruptamente)
- Son enlaces resultantes de la interacción entre los metales de los grupos I y II y los no metales de los grupos VI y VII.
- Son solubles en agua y otras disoluciones acuosas debido al dipolo eléctrico que presentan las moléculas de agua
- Una vez en disolución acuosa son excelentes conductores de electricidad, ya que entonces los iones quedan libres. (Hay una gran variedad de compuestos iónicos que son poco o muy poco solubles en disolución acuosa, también debido al carácter covalente del compuesto y que no permite que el agua separe fácilmente la red cristalina, resultando así en una muy pobre conductividad en disolución)
- En estado sólido no conducen la electricidad, ya que los iones ocupan posiciones muy fijas en la red.Esto se debe a que los iones disueltos de la sal son capaces de acudir al polo opuesto (a su signo) de la pila del circuito y, por ello, este funciona.
Ejemplos:
- Óxido de magnesio (MgO)
 Sulfato de cobre (CuSO4)
Sulfato de cobre (CuSO4) Ioduro de potasio (KI)
Ioduro de potasio (KI) Hidróxido de zinc (Zn(OH)2)
Hidróxido de zinc (Zn(OH)2) Cloruro de sodio (NaCl)
Cloruro de sodio (NaCl) Nitrato de plata (AgNO3)
Nitrato de plata (AgNO3) Fluoruro de litio (LiF)
Fluoruro de litio (LiF) Cloruro de magnesio (MgCl2)
Cloruro de magnesio (MgCl2) Hidróxido de potasio (KOH)
Hidróxido de potasio (KOH) Nitrato de calcio (Ca(NO3)2)
Nitrato de calcio (Ca(NO3)2) Fosfato de calcio (Ca3(PO4)2)
Fosfato de calcio (Ca3(PO4)2)
 Dicromato de potasio (K2Cr2O7)
Dicromato de potasio (K2Cr2O7) Fosfato disódico (Na2HPO4)
Fosfato disódico (Na2HPO4) Sulfuro de hierro (Fe2S3)
Sulfuro de hierro (Fe2S3) Bromuro de potasio (KBr)
Bromuro de potasio (KBr) Carbonato de calcio (CaCO3)
Carbonato de calcio (CaCO3) Hipoclorito de sodio (NaClO)
Hipoclorito de sodio (NaClO) Sulfato de potasio (K2SO4)
Sulfato de potasio (K2SO4) Cloruro de manganeso (MnCl2)
Cloruro de manganeso (MnCl2)
Fuente: http://www.ejemplos.co/20-ejemplos-de-enlace-ionico/#ixzz4PYwMzgsl
No hay comentarios:
Publicar un comentario