Los enlaces covalentes son las fuerzas que mantienen unidos entre sí los átomos no metálicos (los elementos situados a la derecha en la tabla periódica -C, O, F, Cl, ...). Estos átomos tienen muchos electrones en su nivel más externo (electrones de valencia) y tienen tendencia a ganar electrones más que a cederlos, para adquirir la estabilidad de la estructura electrónica de gas noble. Por tanto, los átomos no metálicos no pueden cederse electrones entre sí para formar iones de signo opuesto.
Características:
Ejemplos:
|
- Flúor
 Bromo
Bromo Iodo
Iodo Cloro
Cloro Oxígeno
Oxígeno Agua
Agua Dióxido de carbono
Dióxido de carbono Amoníaco
Amoníaco Metano
Metano Propano
Propano
 Sílice
Sílice Diamante
Diamante Grafito
Grafito Cuarzo
Cuarzo Glucosa
Glucosa Parafina
Parafina Diesel
Diesel Nitrógeno
Nitrógeno Helio
Helio Freón
Freón
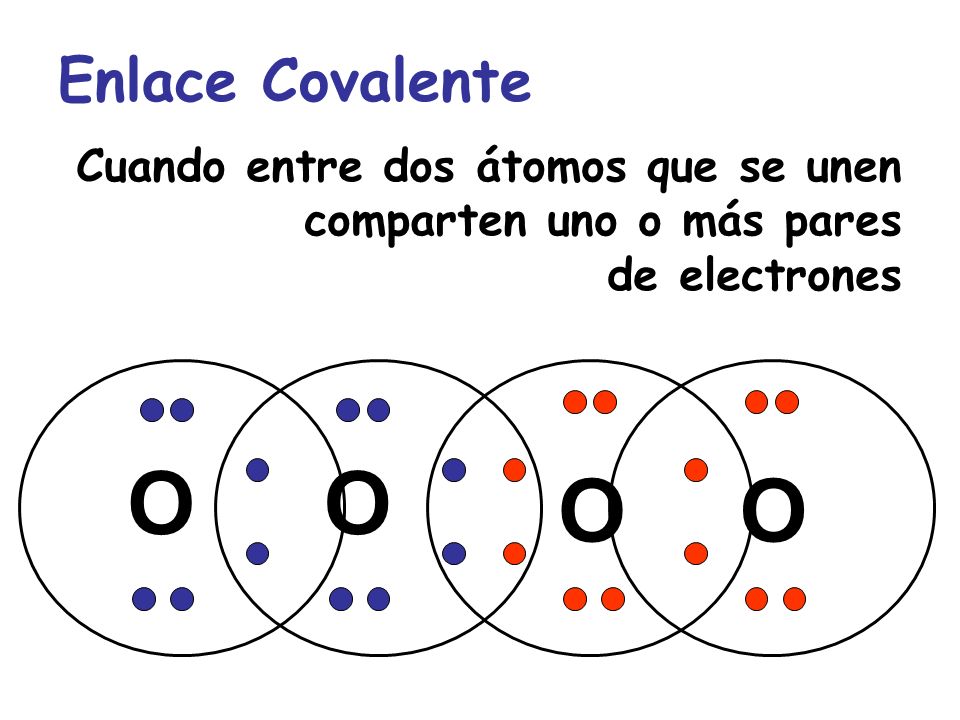
Enlace covalente
ResponderEliminarEl enlace covalente es un modelo de los cuales se parte del estudio de los compuestos que a su vez son las fuerzas que se mantienen unidos entre sí, son átomos no metálicos y están situados a la derecha de la tabla periódica.
Se dice que un enlace covalente es no polar cuando la diferencia de electronegatividad entre los dos átomos unidos es cero.
Un ejemplo de ello son las moléculas homonucleares, la tendencia de estos átomos para atraer electrones hacia su núcleo es igual, por la cantidad de valencia de los átomos y su tendencia para completar electrones los cuales pueden ser: enlaces simples, dobles, y triples.
Enlace simple: cuando se comparte un par de electrones.
Enlace doble: cuando se comparten dos pares de electrones.
Enlace triple: cuando se comparte tres electrones.
Considero que es importante el conocer los tipos de enlace que existen, ya que gracias a este trabajo, pude conocer lo que es un enlace covalente, un enlace simple, un enlace doble y un enlace triple, así mismo como estos son importantes en la química, y por siguiente en la formación de mi aprendizaje.
Autor: Maria Fernanda Canche Bacab